▎Armstrong
2015年以來����,國內(nèi)大分子新藥申報(bào)開始呈現(xiàn)井噴趨勢,2020年申報(bào)數(shù)量已經(jīng)逼近三位數(shù)�,2021年剛剛過半�,申報(bào)數(shù)量已經(jīng)接近100款。熱門靶點(diǎn)過度競爭正在PD-1之后其他靶點(diǎn)重現(xiàn)���,HER2�、IL-4R��、IL-17�、Claudin 18.2、CD47����、多個(gè)checkpoint等都已經(jīng)呈現(xiàn)類似趨勢��。后續(xù)靶點(diǎn)中�,細(xì)胞因子(IL-2�、IL-15等)、腺苷通路(CD73/CD39/A2AR)�、TSLP、Trop2�����、CD38等也正在吸引越來越多的藥企布局����。
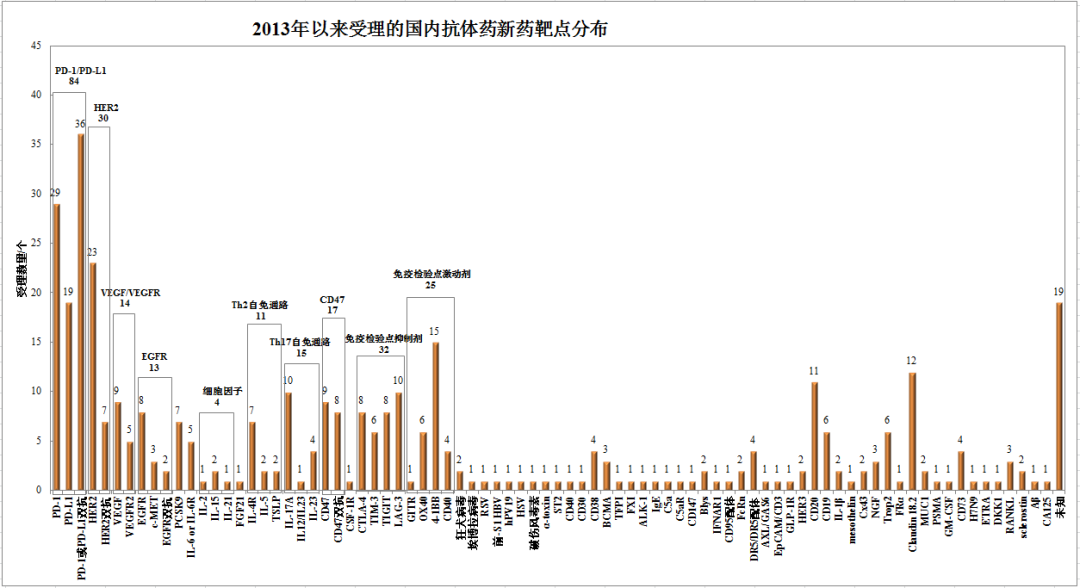
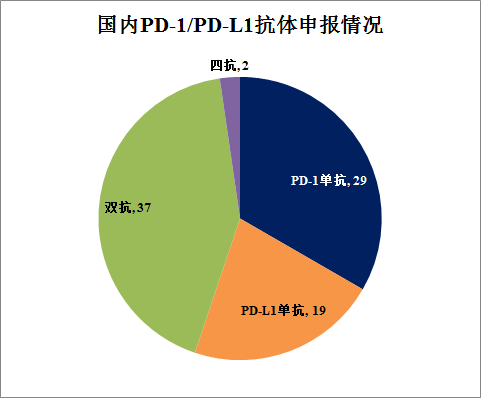
國內(nèi)PD-1/PD-L1抗體的申報(bào)數(shù)量已經(jīng)達(dá)到87款,其中PD-1單抗29個(gè)����,PD-L1單抗19個(gè),PD-1雙抗或PD-L1雙抗37個(gè)�����,四抗2個(gè)����。國內(nèi)方面,4款PD-1抗體已經(jīng)上市����,分別為君實(shí)生物、信達(dá)生物����、恒瑞醫(yī)藥和百濟(jì)神州。另有5款PD-1抗體(康方生物����、譽(yù)衡藥業(yè)、嘉和生物�、復(fù)宏漢霖、樂普生物)申報(bào)上市���,2款PD-L1抗體申報(bào)上市����。FDA方面�����,君實(shí)生物、信達(dá)生物�、康方生物已經(jīng)申報(bào)上市,百濟(jì)神州年內(nèi)遞交上市申請�����。
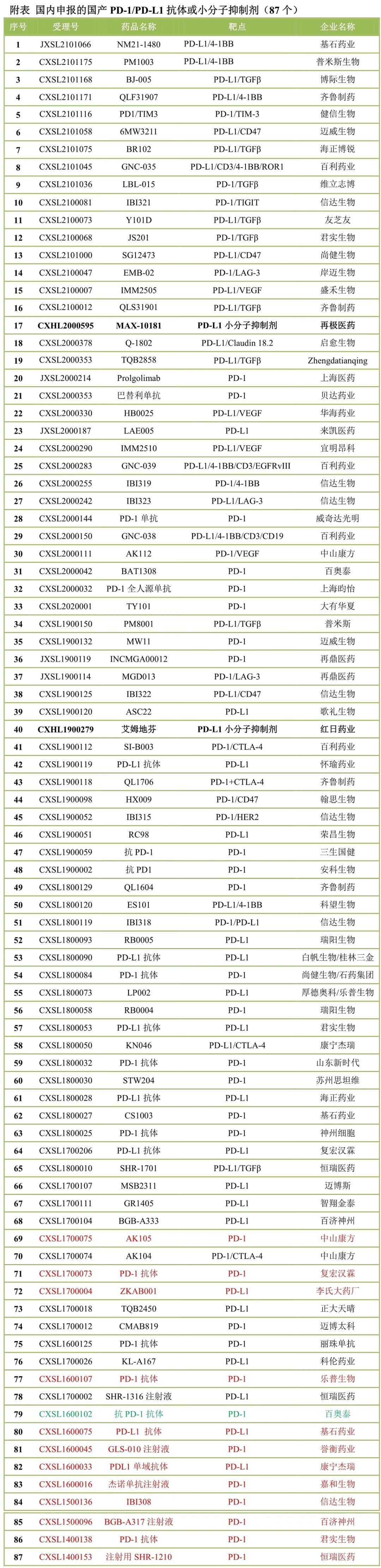
目前�����,PD-1/PD-L1單抗的申報(bào)已經(jīng)很少�,新一代的競爭集中在雙抗。國內(nèi)目前申報(bào)臨床的69款雙抗中���,37款即超過一半為PD-1雙抗或PD-L1雙抗�����。這些PD-1雙抗或PD-L1雙抗中�,康方生物的PD-1/CTLA-4雙抗AK104在多個(gè)適應(yīng)癥早期臨床取得優(yōu)異數(shù)據(jù)�,一些適應(yīng)癥療效數(shù)據(jù)優(yōu)于PD-1+CTLA-4聯(lián)合治療的歷史數(shù)據(jù),而安全性更具有顯著優(yōu)勢���。AK104不僅在國內(nèi)居于領(lǐng)先地位���,在國際上也是進(jìn)展最快的免疫雙抗之一,未來將不斷創(chuàng)造新的紀(jì)錄��。
除PD-1/CTLA-4或PD-L1/CTAL-4外����,PD-(L)1/CD47、PD-(L)1/VEGF�、PD-(L)1/TGFβ、PD-(L)/4-1BB�、PD-(L)1/LAG-3雙抗等也是PD-(L)1雙抗的靶點(diǎn)組合。
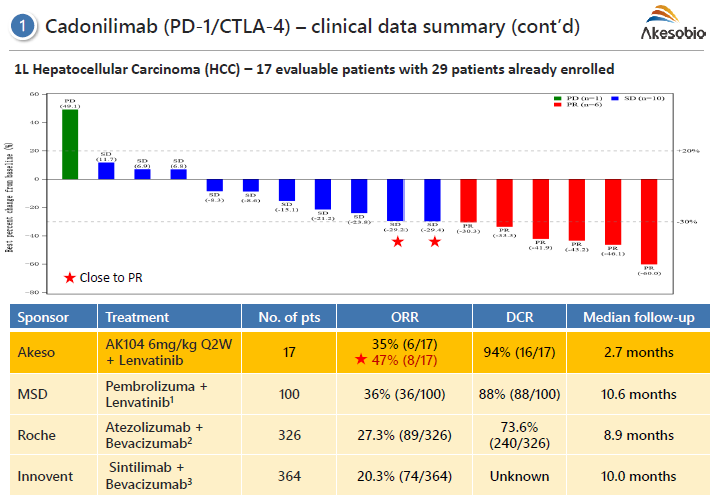
需要注意的是���,有些機(jī)制的雙抗不一定是最好的組合�,需要具體情況具體分析�,如羅氏PD-L1+VEGF聯(lián)合治療在肝癌取得成功,但其實(shí)PD-1抗體+小分子血管抑制劑如侖伐替尼等取得了更好的數(shù)據(jù)����。2021年6月28日,信達(dá)生物宣布NMPA批準(zhǔn)PD-1抗體信迪利單抗聯(lián)合貝伐珠單抗類似藥一線治療晚期肝細(xì)胞癌�����。相比于索拉非尼,該聯(lián)合治療將ORR從8%提高到21%���,mPFS從2.8個(gè)月延長到4.6個(gè)月����。此外��,多家國內(nèi)多家藥以PD-1與侖伐替尼聯(lián)合�����,康方生物則以PD-1/CTLA-4雙抗與侖伐替尼聯(lián)合���,隨訪2.7個(gè)月即取得優(yōu)異療效數(shù)據(jù)�,媲美乃至超過其他PD-1聯(lián)合VEGF抗體或侖伐替尼隨訪10個(gè)月的療效數(shù)據(jù)���。
其他免疫檢驗(yàn)點(diǎn):TIGIT����、LAG-3等今年ASCO會(huì)議�����,一個(gè)重要看點(diǎn)就是LAG-3聯(lián)合Opdivo黑色素瘤三期臨床,意味著又一個(gè)新的免疫檢驗(yàn)點(diǎn)獲得成功�����。國內(nèi)已經(jīng)申報(bào)多款LAG-3融合蛋白�、單抗和雙抗�����。
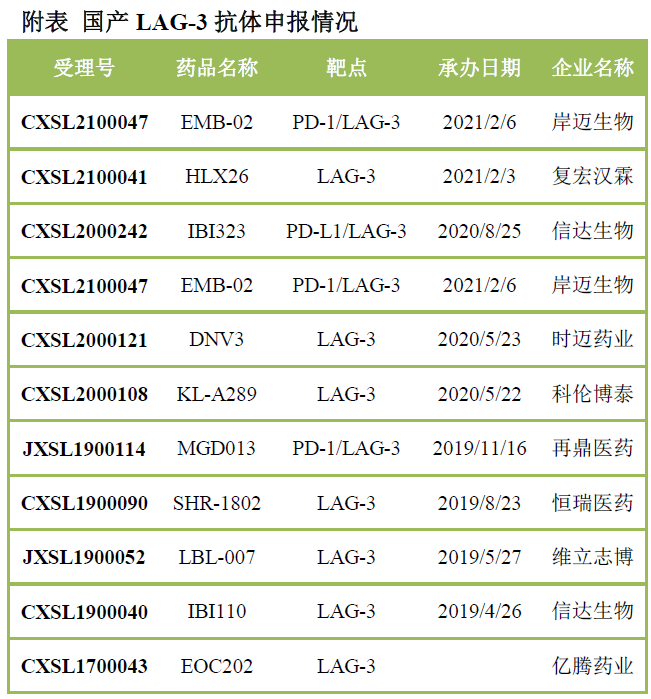
今年ASCO前后����,TIGIT靶點(diǎn)成為跨國藥企布局的重要靶點(diǎn)。百時(shí)美施貴寶15.6億美元引進(jìn)Agenus的TIGIT雙抗�,葛蘭素史克20.7億美元引進(jìn)iTeos的TIGIT單抗。國內(nèi)已經(jīng)申報(bào)6款TIGIT單抗和1款PD-1/TIGIT雙抗�。復(fù)宏漢霖與北生所隋建華課題組均研發(fā)了基于DLE增強(qiáng)Fc effector效應(yīng),進(jìn)而增強(qiáng)抗腫瘤活性的TIGIT抗體��。PD-L1/4-1BB為熱門的雙抗靶點(diǎn)組合�,國內(nèi)已經(jīng)申報(bào)7款4-1BB單抗、4款PD-L1/4-1BB雙抗(科望生物�、齊魯制藥��、基石藥業(yè)�����、普米斯生物)��、1款PD-1/4-1BB雙抗(信達(dá)生物)����,百利藥業(yè)的3款四抗則為PD-L1/4-1BB/CD3/TAA���。此外���,維立志博、德琪醫(yī)藥的PD-L1/4-1BB雙抗也將很快進(jìn)入臨床階段�����。禮進(jìn)生物則通過Fc突變��,增強(qiáng)FcγRIIb親和力��,通過Cross-linking以增強(qiáng)抗腫瘤活性����。Yervoy雖然早早獲批���,但是安全性是一個(gè)巨大問題。國內(nèi)藥企很多在開發(fā)新一代的CTLA-4單抗或雙抗�,如康方生物CTLA-4抗體成為默沙東免疫聯(lián)合治療的重要角色,昂科免疫研發(fā)pH依賴性的CTLA-4抗體���,可能更有效更安全����。
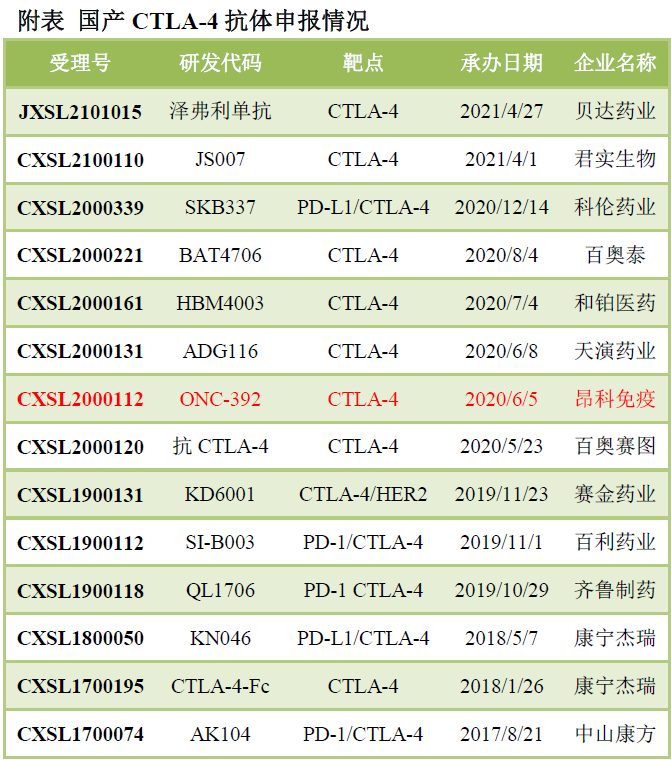
OX40抗體和CD40抗體��,目前申報(bào)臨床還不太多��,分別為6家和4家�����,信達(dá)生物等在研發(fā)PD-L1/OX40雙抗���,百奧賽圖在研發(fā)PD-1/CD40雙抗等。
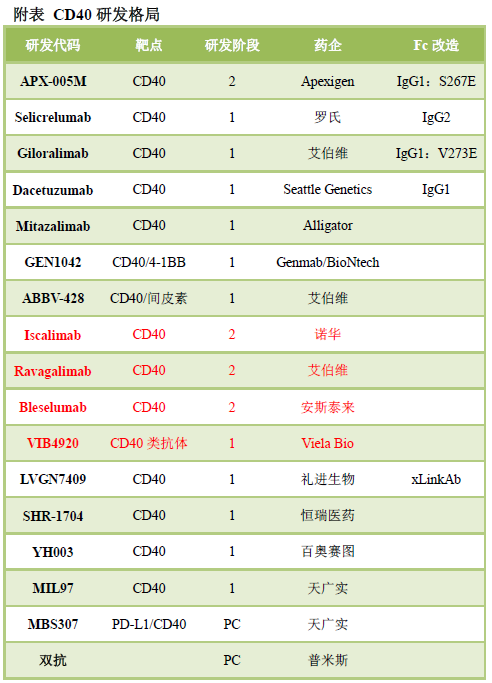
國內(nèi)CD47靶點(diǎn)競爭極為激烈�����,申報(bào)臨床接近20款,包括SIRPα融合蛋白��、單抗�、雙抗等。
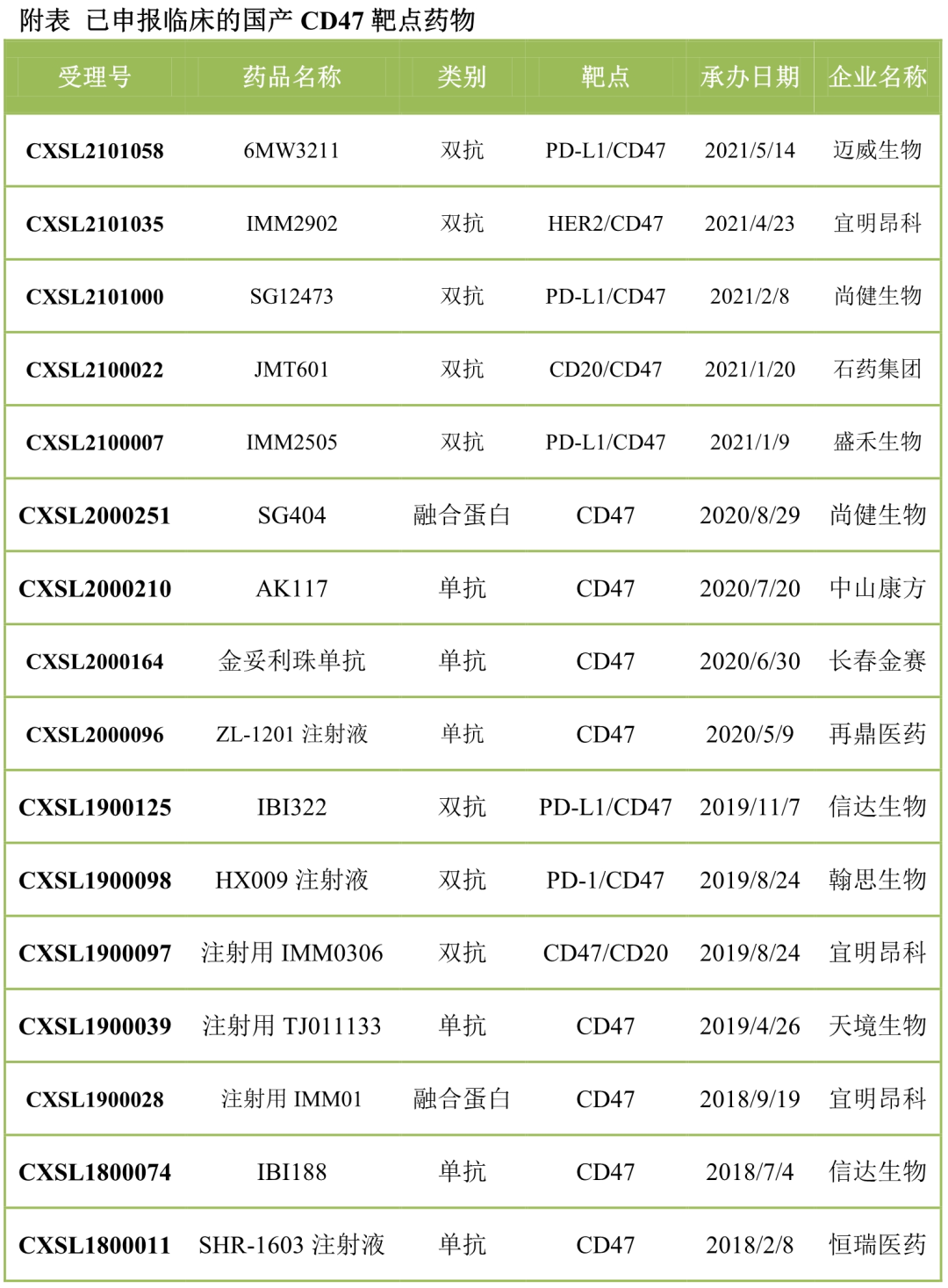
SIRPα融合蛋白��、CD47抗體�、SIRPα抗體都有藥企布局。盡管FortySeven之后����,很多藥企宣稱篩到了沒有血液毒性的CD47單抗,Trillium也稱SIRPα融合蛋白沒有血液毒性����。但目前來看,Magrolimab之后�,SIRPα融合蛋白或新一代CD47抗體確實(shí)血液毒性顯著更弱,但仍然有一定的血液毒性��。以Trillium為例�����,同時(shí)開發(fā)IgG1和IgG4亞型的SIRPα融合蛋白,并將IgG1亞型作為重點(diǎn)�。從今年ASCO前后,Trillium的重心已經(jīng)裝箱IgG4����,很大的一個(gè)原因就是TTI-621因?yàn)槎拘詥栴}(如血小板毒性)只能爬坡到2mg/kg劑量,而TTI-622已經(jīng)爬坡到18mg/kg���,在不同治療窗口下�����,TTI-622取得更好療效����,且安全性仍好于TTI-622�����。目前天境生物����、康方生物的CD47抗體已經(jīng)爬坡到30mg/kg甚至更高��,未來IgG4亞型的SIRPα融合蛋白或CD47抗體,將成為該通路的主要力量���,后續(xù)則重點(diǎn)關(guān)注雙抗和聯(lián)合治療����。
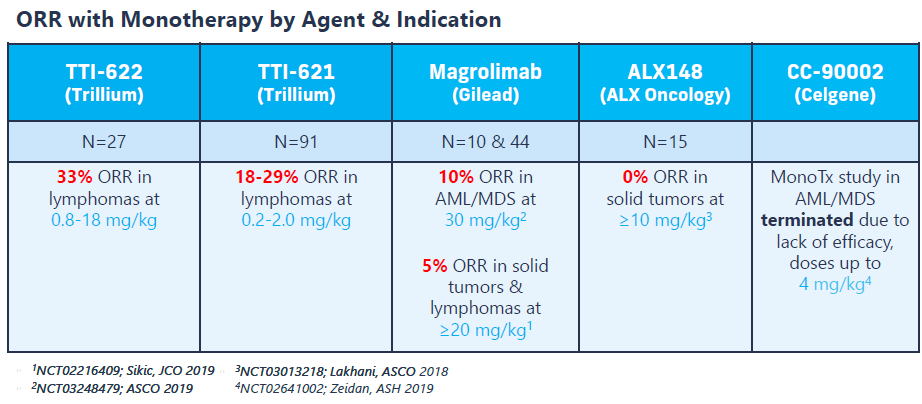
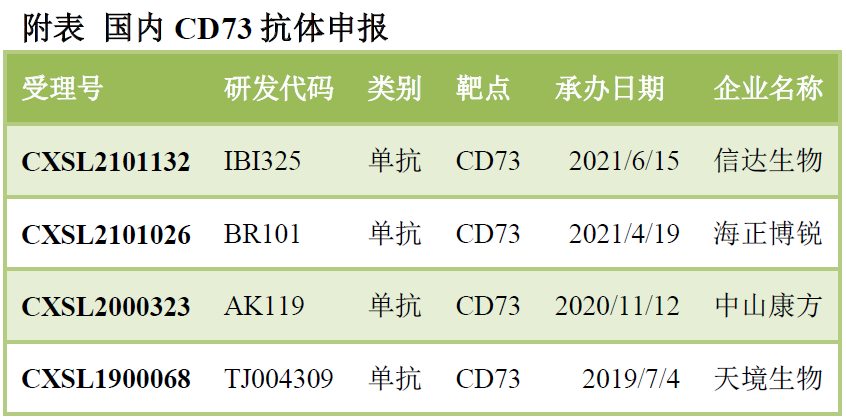
腺苷通路:CD39�����、CD73���、A2ARCD39-CD73-腺苷通路是免疫抑制環(huán)境的重要參與者之一:ATP在CD39作用下轉(zhuǎn)化為AMP���,AMP在CD73作用下轉(zhuǎn)化為腺苷,腺苷與免疫細(xì)胞上的受體結(jié)合產(chǎn)生免疫抑制效應(yīng)���。國內(nèi)已經(jīng)申報(bào)4款CD73抗體�,岸邁生物等布局CD39抗體�,另有多家藥企開發(fā)A2AR抑制劑。
細(xì)胞因子:IL-2�、IL-15、IL-21等恒瑞醫(yī)藥申報(bào)了首個(gè)IL-2��,目前也是唯一處于臨床階段的國產(chǎn)IL-2���。信達(dá)生物自主研發(fā)了IL-2����,君實(shí)生物引進(jìn)了Anwita和志道生物的IL-2����,先聲藥業(yè)引進(jìn)了CD80/IL-2融合蛋白。恒瑞醫(yī)藥和博際生物申報(bào)了IL-15��,先聲藥業(yè)研發(fā)了PD-L1抗體/IL-15融合蛋白���,諾誠健華等也在布局(下圖)���。君實(shí)生物申報(bào)了國內(nèi)首個(gè)IL-21融合蛋白���。
天境生物為IL-7的領(lǐng)先者(從Genexine引進(jìn)),并開發(fā)基于IL-7的多個(gè)抗體融合蛋白���。
丁孚靶點(diǎn)研發(fā)了EGFR抗體/IL-10融合蛋白����,已經(jīng)進(jìn)入臨床研究階段�。2019年6月,該融合蛋白的作用機(jī)制研究發(fā)表在Cancel Cell期刊上��,通訊作者為徐霆博士、傅陽心教授以及西南醫(yī)學(xué)中心的喬健博士�����。2020年4月,傅陽心教授也發(fā)表了一篇EGFR抗體/IL-21融合蛋白的研究文章。胃癌為亞洲國家高發(fā)癌種,國內(nèi)Claudin 18.2的競爭異常激烈,目前剛開布局者已經(jīng)超過30家。藥物形式方面,單抗���、多抗、ADC和CAR-T同臺(tái)競爭�。
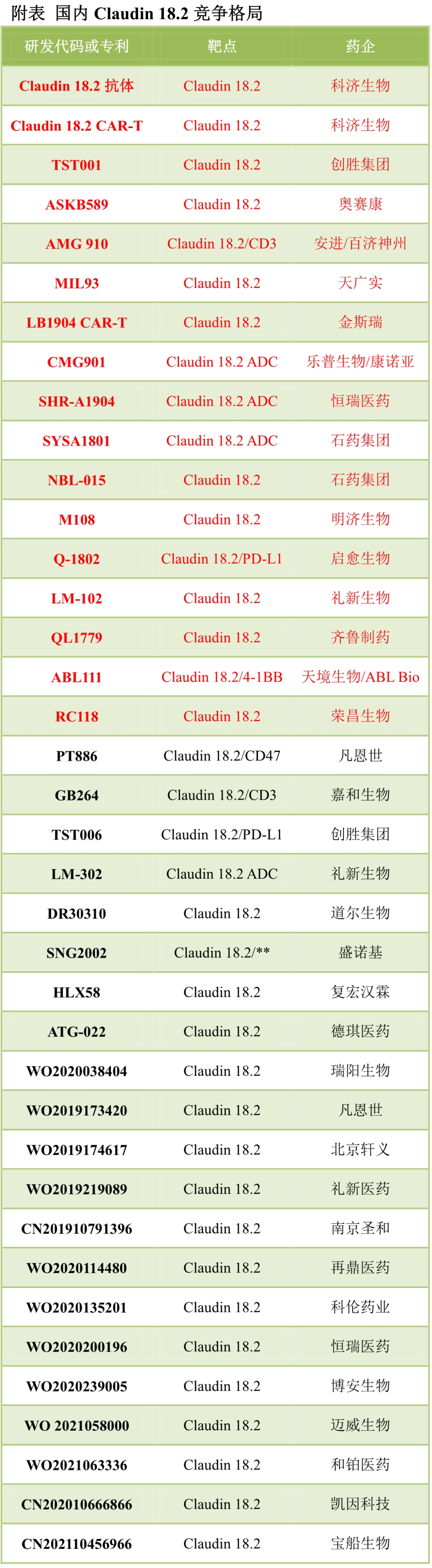
科濟(jì)藥業(yè)Claudin 18.2 CAR-T初步臨床數(shù)據(jù)如下�����,ORR為50%��,中位DoR為4.6個(gè)月�。


康諾亞/樂普生物的CMG901為全球首個(gè)Claudin 18.2 ADC新藥����,臨床前研究發(fā)現(xiàn)抗腫瘤活性顯著優(yōu)于Claudin 18.2單抗�。國內(nèi)ADC很長時(shí)間內(nèi)對標(biāo)T-DM1�,造成單一靶點(diǎn)過度競爭�����。隨著新一輪ADC熱潮了來臨�,Trop2等成為新的熱門靶點(diǎn)����,目前國內(nèi)已經(jīng)有6款Trop2 ADC申報(bào),其中百奧泰已經(jīng)終止,剩余5家����。HER2則進(jìn)入新一代的競爭�����,至少對標(biāo)T-DM1,同時(shí)要面臨DS-8201的競爭����。新碼生物的ARX788、科倫藥業(yè)的A166都表現(xiàn)出不錯(cuò)的療效數(shù)據(jù)��,ARX788在安全性上優(yōu)勢則更為明顯��。多發(fā)性骨髓瘤大分子新藥的競爭聚焦在CD38-BCMA-GPRC5D,國內(nèi)已經(jīng)申報(bào)3款CD38單抗�,1款CD38/CD3雙抗和3款BCMA/CD3雙抗���。強(qiáng)生GPRC5D/CD3已經(jīng)取得很好的臨床數(shù)據(jù)��,優(yōu)瑞科與MSKCC聯(lián)合研發(fā)的GPRC5D CAR-T也剛剛與賽諾菲達(dá)成重磅交易�����。
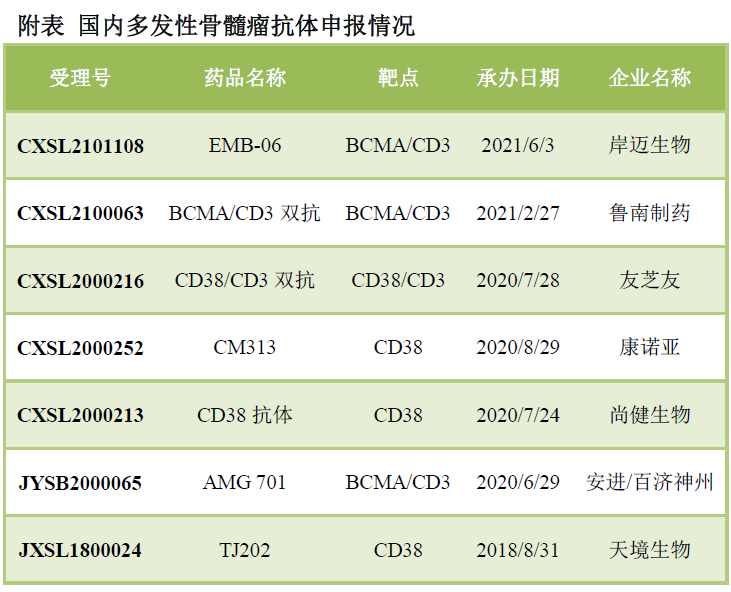
Th2通路在濕疹和哮喘的研究已經(jīng)非常清楚,2020年Dupixent銷售額已經(jīng)達(dá)到40億美元����。國內(nèi)已經(jīng)申報(bào)7款I(lǐng)L-4R抗體��、2款I(lǐng)L-5抗體和2款TSLP抗體�。
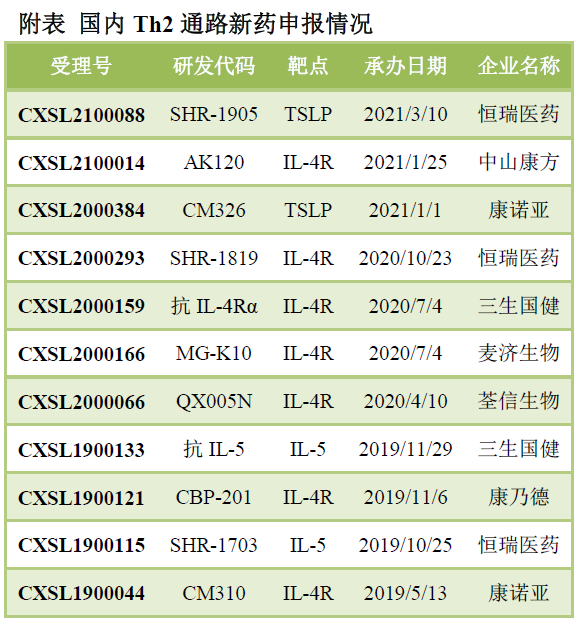
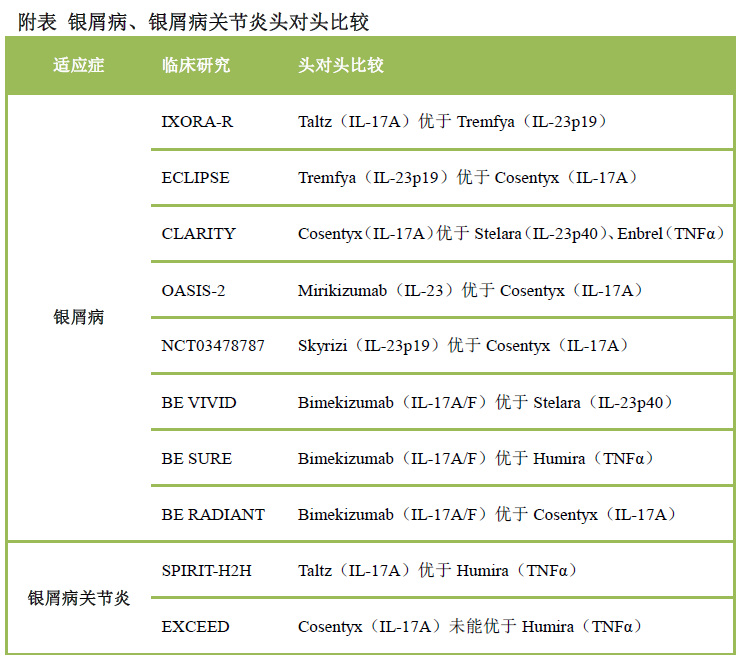
康諾亞在IL-4R抗體和TSLP抗體都處于第一名的位置�����,是國內(nèi)Th2通路當(dāng)之無愧的領(lǐng)導(dǎo)者��。IL-4R抗體CM310起效比dupixent更快,給藥后7天TRAC即顯著下降, 而Dupilumab給藥后15天才有顯著下降�����。治療特應(yīng)性皮炎的1b/2a期臨床中,CM310給藥后6周的療效數(shù)據(jù)即超過Dupilumab治療16周的數(shù)據(jù)。CM310有望成為同類最佳的IL-4R抗體����。安進(jìn)/阿斯利康的TSLP抗體已經(jīng)申報(bào)上市�����,康諾亞國內(nèi)申報(bào)了首個(gè)TSLP抗體CM326����。CM326的體外生物學(xué)活性比Tezepelumab強(qiáng)5倍左右。Th17通路在銀屑病�����、銀屑病關(guān)節(jié)炎���、強(qiáng)制性脊柱炎等取得成功����,歐美已經(jīng)上市多款I(lǐng)L-17抗體和IL-23抗體�����。2020年����,Th17通路抗體藥物市場規(guī)模已經(jīng)達(dá)到150億美元���。
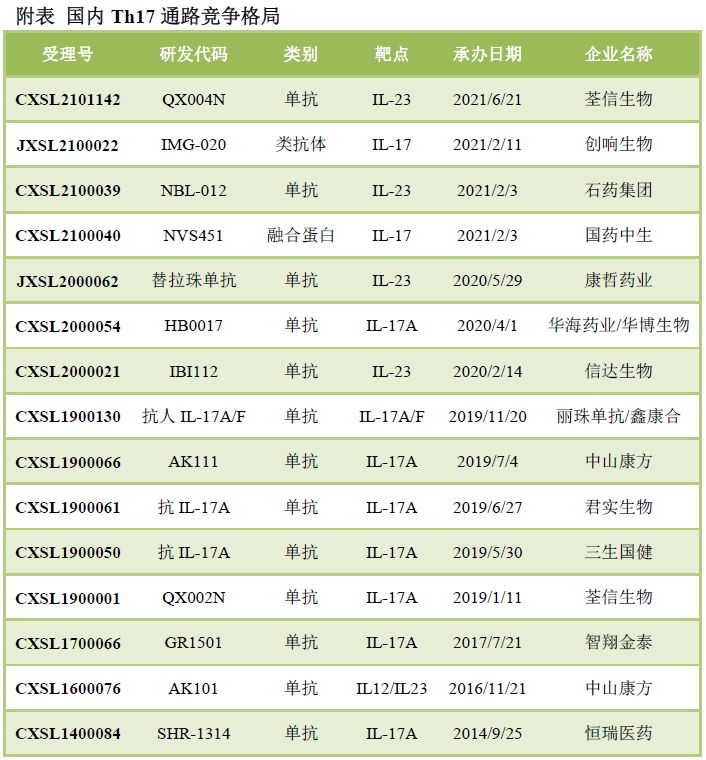
從歐美大量頭對頭臨床試驗(yàn)可以看出,IL-23抗體和IL-17A/F普遍表現(xiàn)出比IL-17抗體更好的療效。國內(nèi)IL-17靶點(diǎn)中���,僅鑫康合/麗珠單抗開發(fā)的是IL-17A/F抗體����,其他均為IL-17A抗體���。
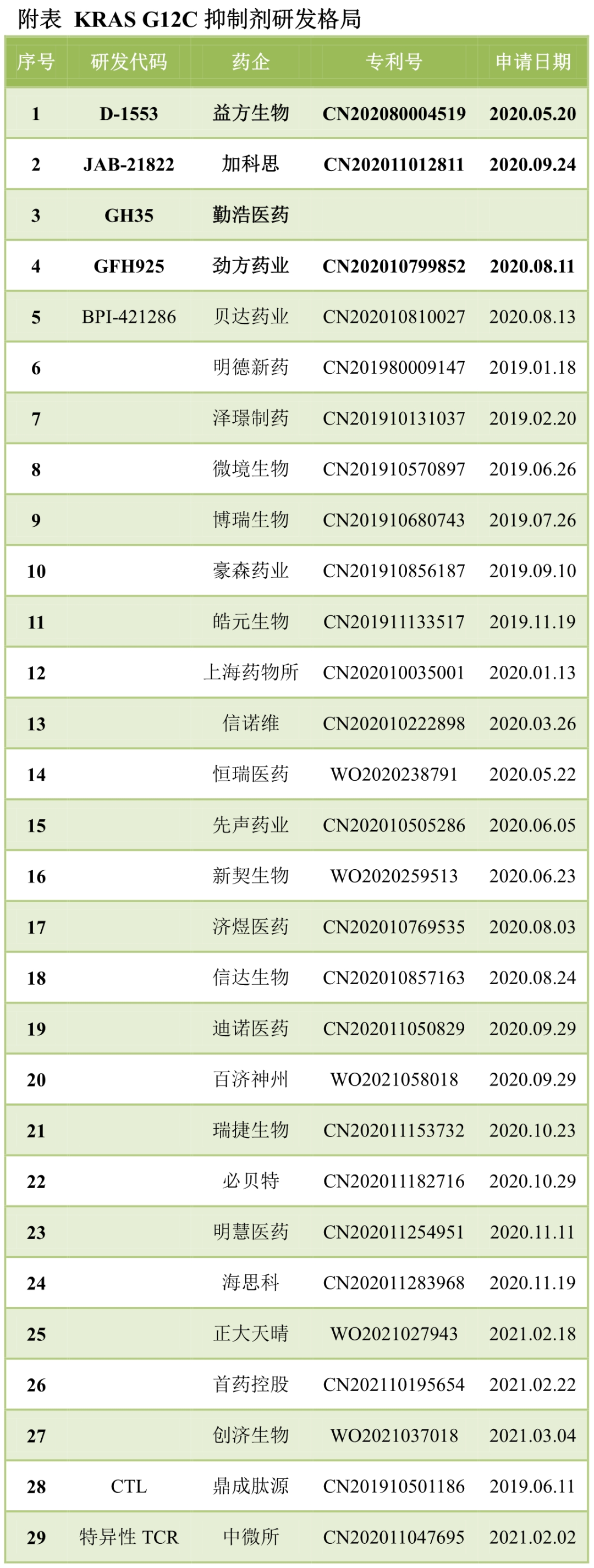
國內(nèi)研發(fā)抗病毒抗體的相對較少,目前僅泰諾麥博��、邁威生物���、華北制藥和智翔醫(yī)藥等申報(bào)了抗病毒抗體�����。泰諾麥博的主要技術(shù)平臺(tái)為人單B細(xì)胞測序��。由于自身免疫耐受的限制���,天然全人源抗體更易于獲得針對外源抗原的克隆,抗病毒抗體即一個(gè)理想領(lǐng)域�����。新冠疫情中�,Vir Bio��、再生元��、中微所/君實(shí)生物、清華大學(xué)/騰盛博藥�����、丹序生物/百濟(jì)神州的中和抗體都來自于康復(fù)患者的天然全人源抗體���。邁威生物則與同濟(jì)大學(xué)安毛毛團(tuán)隊(duì)合作,開發(fā)多個(gè)抗病毒或抗細(xì)菌抗體新藥���。TFPI通過抑制FVIIa-TF-FXa復(fù)合物削弱外源性凝血途徑��,康寧杰瑞KN057為國內(nèi)首個(gè)TFPI抗體�����。FXI抗體則用于抗凝�,科倫藥業(yè)申報(bào)了國內(nèi)首個(gè)FXI抗體SKB336�。仁會(huì)生物、博槿生物等也在布局���。不過根據(jù)拜耳Osocimab的數(shù)據(jù)��,抗凝效果優(yōu)于依諾肝素��,但與阿哌沙班相比�����,未達(dá)到非劣效終點(diǎn)���。2020年12月����,阿斯利康以390億美元收購Alexion�,補(bǔ)體藥物一時(shí)備受關(guān)注。前不久�����,Apellis的C3靶向環(huán)肽獲得FDA批準(zhǔn)����,療效顯著優(yōu)于Alexion的C5抗體Soliris。國內(nèi)方面�,天境生物申報(bào)了C5aR抗體���,康景生物申報(bào)了CRIg-CFH融合蛋白,信達(dá)生物申報(bào)了VEGFR/CR1融合蛋白����。此外,科越醫(yī)藥(C5抗體/CFH融合蛋白)���、天辰生物����、康諾亞(MASP-2抗體)����、康普美特等也在布局補(bǔ)體藥物����。系統(tǒng)性紅斑狼瘡:BLyS、IFNAR1葛蘭素史克BLyS抗體貝利木單抗為FDA五十多年批準(zhǔn)的第一款狼瘡新藥�����。榮昌生物的泰它西普為TACI-Fc融合蛋白�,已經(jīng)獲批上市�����。安進(jìn)/百濟(jì)神州申報(bào)了BLyS/ICOS雙功能蛋白AMG 570���。非主流靶點(diǎn)或治療領(lǐng)域:Aβ等隨著過度競爭日趨激烈,越來越多的藥企嘗試布局更為偏僻的賽道或靶點(diǎn)����。如恒瑞醫(yī)藥申報(bào)了首個(gè)Aβ抗體,用于治療阿爾茨海默癥���?����?氯A珠博士創(chuàng)立安濟(jì)盛��,聚焦骨科新藥的研發(fā)�,已經(jīng)申報(bào)DKK1����。安源醫(yī)藥申報(bào)了首個(gè)FGF21-Fc融合蛋白,東陽光申報(bào)了首個(gè)GLP-1/FGF21雙功能融合蛋白��。多禧生物申報(bào)了首個(gè)國產(chǎn)MUC1 ADC新藥,思路迪申報(bào)了首個(gè)AXL-GAS6通路的GAS融合蛋白��。鴻運(yùn)華寧聚焦GPCR抗體研發(fā)��,申報(bào)了GLP-1R抗體/GLP-1融合蛋白���。相比于大分子���,小分子領(lǐng)域的過度競爭不遑多讓。以KRAS G12C為例�����,短短兩年時(shí)間里�,公開布局的藥企已經(jīng)接近30家�����。
總結(jié)
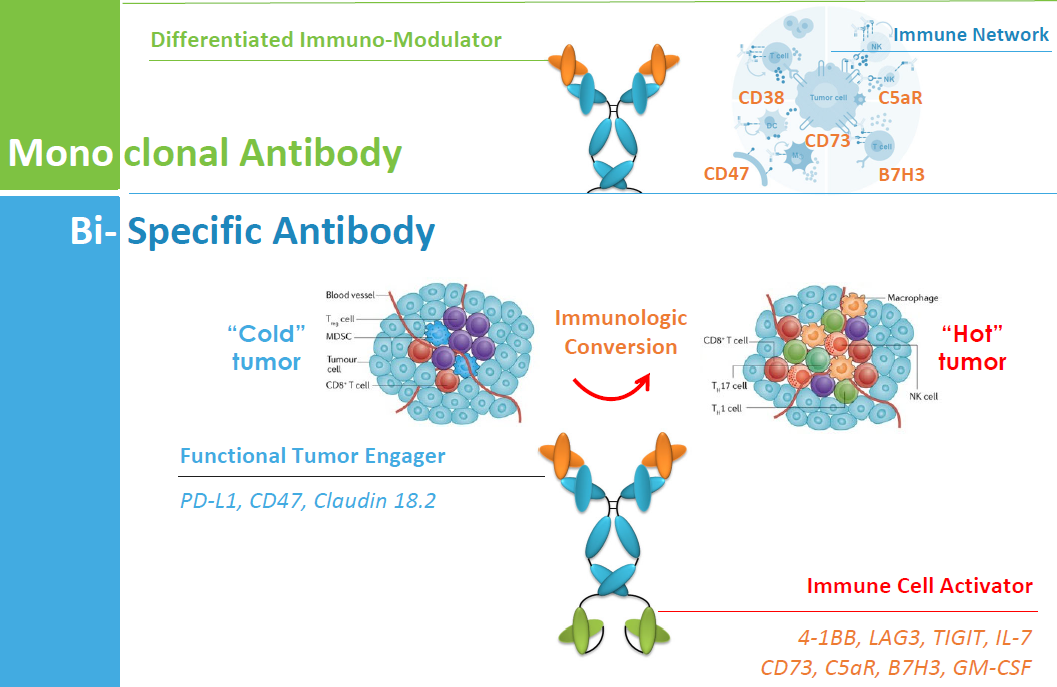
國內(nèi)的新藥研發(fā)格局��,許多熱門靶點(diǎn)的競爭依然非常激烈�����,并不斷在新獲驗(yàn)證的潛在明顯靶點(diǎn)重復(fù)相同的故事。與此同時(shí)�,也要注意藥企普遍以差異化設(shè)計(jì)為底線,以尋求潛在的臨床優(yōu)勢���?���?贵w工程(如禮進(jìn)xLinkAb技術(shù)改進(jìn)crosslinking�、百濟(jì)神州去除PD-1抗體的ADCP效應(yīng))、新藥物形式(如Claudin 18.2靶點(diǎn)��,雙抗��、ADC�、CAR-T均有藥企布局)、雙抗靶點(diǎn)理性組合與設(shè)計(jì)(如康方生物的PD-1/CTLA-4雙抗)�����、聯(lián)合治療探索等���。與此同時(shí)�,也有越來越多的企業(yè)積極布局原創(chuàng)創(chuàng)新����,如Immune-Onc的髓系細(xì)胞檢驗(yàn)點(diǎn)�����、石藥集團(tuán)的Cx43抗體等等�����,多采取與頂尖華人科學(xué)家合作��,基于其基礎(chǔ)研究進(jìn)行轉(zhuǎn)化���。無論是基于新技術(shù)尋求BIC,還是基于創(chuàng)新性基礎(chǔ)研究尋求FIC���,最終落點(diǎn)都在于臨床價(jià)值和患者需求����。可預(yù)見的時(shí)間里��,me-better或BIC仍然是中國生物醫(yī)藥的主要?jiǎng)?chuàng)新力量��,F(xiàn)IC也將在踏實(shí)的積累之下慢慢成長����。
